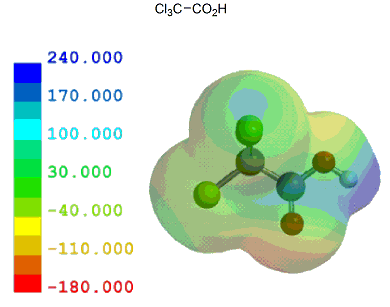
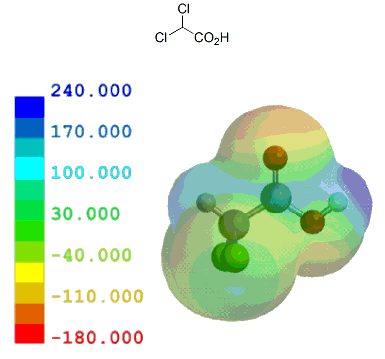
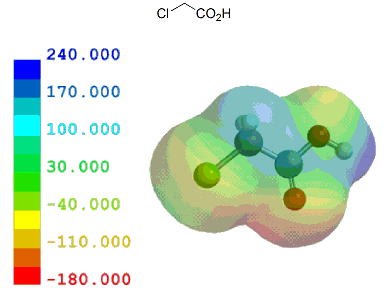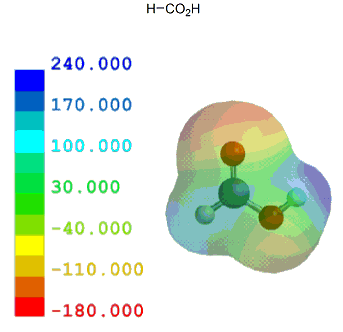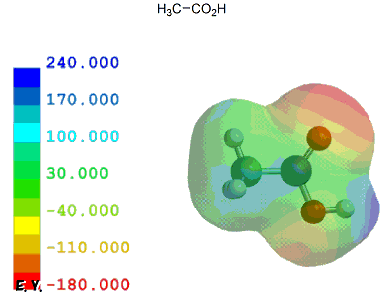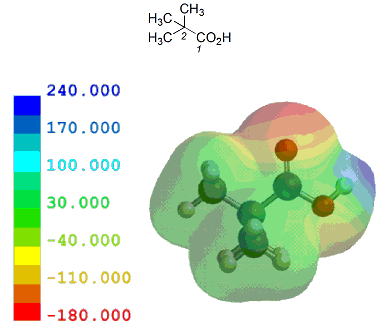ここでは、酢酸を基準として、いくつかの一般的な置換カルボン酸を元に計算結果とpKa実測値を比較しながらカルボン酸α位の置換基効果がどの程度かを見ておく。
(※エネルギー値は計算結果をそのまま記載しているが、同一分子でも小数点2,3桁以下は計算毎にズレを生じるため気にする必要はない。)
共役塩基(カルボキシレートイオン)が安定なほどカルボン酸はプロトン(H+)を放出し易いことになり、その酸性度は強くなる。言い換えれば、α位に電子供与性基があるとカルボキシル基の隣が電子豊富となるため、酸性度は弱まる。逆に、電子吸引性基があるとカルボキシル基の隣が電子不足となるため、酸性度は強まる。
以下のように、誘起効果のみで考えることができる置換カルボン酸は、他に目立った相互作用がないためか、静電ポテンシャル分布/局所イオン化ポテンシャル分布いずれとも実測値とのきれいな相関が見られる。